Immunzelltherapeutika / ATMP
Die Abteilung Immunzelltherapeutika/ATMP übernimmt in erster Linie Aufgaben im Bereich der GMP-konformen Herstellung sogenannter Advanced Therapy Medicinal Products (ATMP, deutsch: Arzneimittel für neuartige Therapien). Meist in Kooperation mit verschiedenen industriellen und akademischen Partnern werden hierbei in Reinräumen Zelltherapeutika nach GMP-Leitlinien hergestellt, abgefüllt und im Einklang mit dem Arzneimittelgesetz für die Anwendung am Patienten freigegeben. Beispiele für solche Zelltherapeutika sind etwa aus mesenchymalen Stromazellen (MSC) gewonnene, immunsuppressiv wirksame Zellpräparate zur Behandlung der Transplantat-gegen-Wirt-Reaktion (Graft-versus-Host Disease, GvHD) nach allogener Stammzelltransplantation, oder auch gentechnisch modifizierte sog. CAR-T-Zell-Präparate zur Behandlung maligner hämatopoietischer Erkrankungen wie des B-Zell-Lymphoms (B-Non-Hodgkin-Lymphom) oder des multiplen Myeloms.
Im Rahmen der Herstellung der genannten Präparate ist auch die Durchführung einer ganzen Reihe von Kontrolluntersuchungen erforderlich. Dabei werden sowohl die hergestellten Präparate auf Ihre Qualität hin überprüft als auch ein mikrobiologisches Monitoring der an der Herstellung beteiligten Mitarbeiterinnen und Mitarbeiter durchgeführt. Auch diese Untersuchungen werden größtenteils vor Ort innerhalb des Institut durchgeführt.
Ein weiteres Aufgabengebiet der Abteilung besteht in der Entwicklung weiterer sogenannter Immunzelltherapeutika. Dies sind zelluläre Arzneimittel, die aus verschiedenen Zelltypen der Fraktion der weißen Blutkörperchen (Leukozyten) gewonnen werden, etwa aus hämatopoietischen Stammzellen, T-Zellen, B-Zellen oder auch unterschiedlichen Subtypen dendritischer Zellen. Zum Einsatz kommen sollen solche neuartigen Zelltherapeutika in erster Linie bei schweren Erkrankungen des hämatopoietischen Systems wie Leukämien sowie bei malignen Erkrankungen wie Kopf- und Hals- oder Hauttumoren. Aber auch Patienten mit schweren Erkrankungen aus dem autoimmunen Formenkreis, also bei Erkrankungen, die dazu führen, dass das Immunsystem gesunde Zellen des eigenen Körpers angreift und zerstört, wie der systemische Lupus erythematodes, könnten von solchen Zelltherapeutika profitieren.
Abteilungsleitung
Team Immunzelltherapeutika / ATMP

Prof. Dr. Bernd Jahrsdörfer
Abteilungsleiter
Schwerpunkte
Leiter Herstellung und Sachkundige Person nach AMG und AMWHV


Carolin Ludwig
Schwerpunkte
Laborleitung Forschung & Entwicklung

Luisa Zanella
Schwerpunkte
Gruppenleitung

Christiane Vieweg
Schwerpunkte
stellv. Gruppenleitung
Reinraumoperatoren
Stephen Bosher
Angela Claß
Tobias Heinrich
Annika Hirschle
Michael Kögler
Julia Lanzinger
Laura Lehmann
Sarah Lehn
Impressionen aus dem Team
Aktuelle GMP-Herstellung (GMP Manufacturing)
Das Präparat „Humane allogene MSC, expandiert, kryokonserviert (Obnitix)“wird als ATMP bei Patienten mit steroid-refraktärer akuter Graft-versus-Host Disease (GvHD) nach allogener Stammzelltransplantation angewandt. Studien zeigen gute Ansprechraten bei gleichzeitig günstigem Nebenwirkungsprofil. Seit 2022 wird Obnitix im Lohnauftrag für die medac GmbH am Institut Ulm des DRK-Blutspendedienstes hergestellt. Aktuell wird das Produkt im Rahmen einer § 4b-Genehmigung des Paul-Ehrlich-Instituts vertrieben und verabreicht.
1. Gewinnung der Zellen
Die Herstellung von Obnitix beginnt mit der Isolation von mesenchymalen Stromazellen (MSC) aus humanem Gewebe, meist aus dem Knochenmark, dem Fettgewebe oder der Nabelschnur. Diese Gewebequellen bieten eine hohe Zellviabilität und -qualität. Die Zellen werden durch mechanische und enzymatische Verfahren aufbereitet, um eine möglichst reine MSC-Population zu gewinnen.
2. Expansion der Zellen
Nach der Isolation erfolgt die Expansion der MSC in speziellen Kulturmedien, die auf die Bedürfnisse dieser Zellen abgestimmt sind. Die Zellen werden in kontrollierten biopharmazeutischen Einrichtungen unter strengen Bedingungen (Good Manufacturing Practice = GMP) kultiviert. Die Arbeiten werden dabei von geschulten und qualifizierten Operatoren an Sterilarbeitsbänken der Klasse A in Reinräumen der Klasse B durchgeführt. Während dieser Phase wird unter anderem auch die Proliferation der Zellen überwacht, um sicherzustellen, dass eine ausreichende Zahl viabler Zellen erreicht wird. Die Expansion erfolgt in speziellen Zellkulturflaschen, wobei regelmäßig Medienwechsel vorgenommen werden, um ein optimales Wachstum zu gewährleisten.
3. Kryokonservierung
Nach der Expansion werden die MSC für die Lagerung und den späteren Einsatz kryokonserviert. Dies geschieht durch das Einfrieren der Zellen bei Temperaturen < –150°C in Anwesenheit von Kryoprotektiva wie Dimethylsulfoxid (DMSO). Diese Methode ermöglicht eine langfristige Lagerung der Zellen, ohne deren Lebensfähigkeit zu stark zu beeinträchtigen.
4. Qualitätssicherung
Während der gesamten Herstellung werden umfassende Qualitätskontrollen durchgeführt, um die Sicherheit, Reinheit und Wirksamkeit des Produkts sicherzustellen. Dazu gehören mikrobiologische Untersuchungen mittels BacT/Alert, die Charakterisierung von Oberflächenmarkern mittels Durchflusszytometrie (FACS), sowie eine Testung auf das Vorhandensein von Mykoplasmen und Endotoxin. Zusätzlich ist für die Freigabe die Erfüllung mehrerer Spezifikationsparameter für jeden einzelnen abgefüllten Präparatebeutel erforderlich (s.a. Spezialdiagnostik ATMP).
Impressionen aus dem Reinraum
5. Klinische Anwendung von MSC: MSC finden Anwendung in verschiedenen medizinischen Bereichen:
- Regenerative Medizin: Grundsätzlich sind MSC auch in der Lage, beschädigtes Gewebe zu regenerieren. Sie fördern die Heilung von Verletzungen und degenerativen Erkrankungen, indem sie entzündungshemmende Zytokine freisetzen und die Proliferation von körpereigenen Zellen unterstützen. Das Präparat Obnitix ist hierfür jedoch aktuell nicht zugelassen.
- Immunmodulation: Ein wichtiger Anwendungsbereich von Obnitix ist die Behandlung von steroid-refraktärer GvhD nach allogener Stammzelltransplantation. Da MSC jedoch grundsätzlich die Fähigkeit haben, die Immunantwort zu modulieren, indem sie die Aktivierung von T-Zellen hemmen und die Bildung von regulatorischen T-Zellen fördern, könnte ihre Anwendung in Zukunft auch bei Autoimmunerkrankungen wie der rheumatoiden Arthritis oder dem systemischen Lupus erythematodes von Nutzen sein.
- Klinische Studien: MSC werden derzeit in verschiedenen klinischen Studien untersucht, um ihre Sicherheit und Wirksamkeit bei unterschiedlichen Indikationen wie chronisch entzündlichen Erkrankungen und degenerativen Erkrankungen zu testen.
6. Immunmodulatorische Effekte von MSC
- Modulation der T-Zell-Aktivität: MSC haben die Fähigkeit, die Aktivierung und Proliferation von T-Zellen zu hemmen. Mutmaßlich geschieht dies über die Expression von inhibierenden Molekülen (z. B. PD-L1, Indoleamin-2,3-dioxygenase), die die T-Zell-Aktivierung unterdrücken und die Apoptose von aktivierten T-Zellen induzieren.
- Stimulation regulatorischer T-Zellen (Tregs): MSC fördern die Differenzierung und Aktivierung regulatorischer T-Zellen, die eine wichtige Rolle bei der Aufrechterhaltung der immunologischen Selbsttoleranz spielen.
- Förderung immunsuppressiver und Reduktion proinflammatorischer Zytokine: MSC produzieren Zytokine wie Interleukin 10 (IL-10) und Transforming Growth Factor β (TGF-β), die die Differenzierung von naiven T-Zellen zu Tregs fördern und die Aktivität entzündungsfördernder Zellen (z. B. Th1- und Th17-Zellen) hemmen.
- Wechselwirkungen mit antigenpräsentierenden Zellen (APCs): MSC beeinflussen die Funktion antigenpräsentierender Zellen, indem sie ihre Reifung und Aktivierung hemmen, was eine Verminderung der Präsentation von Antigenen und damit der T-Zell-Aktivierung zur Folge hat.
- Vermittlung von Mikroumgebungsänderungen:MSC tragen zur Schaffung einer immunologisch toleranten Mikroumgebung bei, indem sie die Freisetzung von Zytokinen und Chemokinen fördern, die eine tolerogene Umgebung schaffen und so die Aktivierung von Immunzellen unterdrücken.
- Einfluss auf das Homing- und Infiltrationsverhalten von Immunzellen: Durch die Ausschüttung von Chemokinen und anderen Faktoren können MSC die Infiltration von T-Zellen in Gewebe hemmen und so eine Gewebsschädigung reduzieren.
Methodenspektrum
1. Durchflusszytometrische Charakterisierung immunsuppressiv wirksamer mesenchymaler Stromazellen
Die Durchflusszytometrie ist eine leistungsstarke Methode zur Analyse und Charakterisierung von Zellen in Suspension. Dabei werden Zellen in einem Flüssigkeitsstrom einzeln durch einen Laserstrahl geleitet. Die Streuung des Lichts und Fluoreszenzsignale, die durch spezifisch gebundene fluoreszierende Antikörper erzeugt werden, liefern Informationen über die Größe, Granularität und das Vorhandensein bestimmter Oberflächen- oder intrazellulärer Marker. Diese Technik ermöglicht die gleichzeitige Messung mehrerer Parameter pro Zelle und wird häufig in der Immunologie, Onkologie und Stammzellforschung eingesetzt. Durch die hohe Geschwindigkeit und Präzision ist die Durchflusszytometrie ein unverzichtbares Werkzeug zur Untersuchung heterogener Zellpopulationen.
Die durchflusszytometrische Charakterisierung mesenchymaler Stromazellen (MSC) ermöglicht eine genaue Analyse ihrer Oberflächenmarker und damit indirekt auch ihrer Funktion. MSC wirken entzündungshemmend, was sie für eine Therapie der GvhD sowie potentiell von Autoimmunerkrankungen und Transplantatabstoßung interessant macht. Typische MSC-Marker wie CD73, CD90 und CD105 werden durchflusszytometrisch erfasst, während die Expression hämatopoetischer Marker wie CD34, CD45 und CD14 ausgeschlossen wird, um eine möglichst reine MSC-Population zu bestätigen. Immunmodulatorische Moleküle wie HLA-G, PD-L1 und IDO sowie intrazelluläre Proteine wie Interleukin 10 (IL-10) und Transforming Growth Factor β (TGF-β) tragen zur immunsuppressiven Wirkung bei und können mit dieser Methode ggf. ebenfalls analysiert werden. Die Methode ist entscheidend, um MSC für eine klinische Anwendung freizugeben.
2. Bakterielle Kontamination mittels BacT/Alert gemäß Europäischer Pharmacopoeia
Für die Überprüfung pharmazeutischer Produkte auf mikrobielle Verunreinigungen gemäß Europäischer Pharmacopoeia wird an unserem Institut das automatisierte System BacT/Alert 3D eingesetzt. Für die Untersuchung werden Flaschen mit speziellen Nährmedien verwendet, die zur Wachstumsförderung von Mikroorganismen geeignet sind. Die zu testenden Proben werden hierfür in die BacT/Alert-Flaschen injiziert und dann im BacT/Alert-3D-Gerät bebrütet. Für einen definierten Zeitraum werden dann kontinuierlich die CO₂-Werte in den einzelnen Flaschen überwacht. Ein Anstieg des CO2-Wertes, welcher über einen pH-abhängigen Farbumschlag des Nährmediums detektiert wird, weist dabei auf mikrobielles Wachstum hin. Das BacT/Alert-System liefert innerhalb weniger Tage Ergebnisse, was einen zeitnahen Nachweis mikrobieller Verunreinigungen ermöglicht. Die Anwendung dieser Methode ist entscheidend für die Qualitätssicherung und die Gewährleistung der Sicherheit von Advanced Therapy Medicinal Products (ATMPs) und anderen pharmazeutischen Produkten.
3. Endotoxinmessung mittels LAL-Assay
Von Bakterien produzierte Endotoxine können im Körper schwerwiegende Entzündungsreaktionen auslösen. Um die Abwesenheit von Endotoxinen in pharmazeutischen Produkten, Medizinprodukten und biologischen Proben zu gewährleisten, wird aktuell der sogenannte LAL-Assay (Limulus-Amöbozyten-Lysat) eingesetzt. Dieser Assay basiert auf einer Gerinnungsreaktion zwischen Endotoxin und einem Lysat aus Blutzellen des Pfeilschwanzkrebses (Limulus polyphemus). Diese Reaktion kann je nach verwendetem Testtyp (Gel-Clot, Chromogen oder Turbidimetrie) durch Trübung, Farbänderung oder Fluoreszenz gemessen werden. Der LAL-Assay ist äußerst sensitiv (≤ 1,0 EU/ml) und wird weltweit zur Qualitätssicherung eingesetzt, um die Sicherheit von injizierbaren Arzneimitteln und Medizinprodukten zu gewährleisten.
Neben dem klassischen LAL-Assay wird zunehmend der sogenannte Rekombinante Faktor C (rFC)-Assay als Artenschutz-konforme Alternative zur Endotoxinmessung mittels LAL-Assay eingesetzt. Der rFC-Assay basiert auf einem synthetisch hergestellten, rekombinanten Protein, das den ersten Schritt der Endotoxinkaskade des LAL-Assays nachahmt, ohne auf das Blut von Pfeilschwanzkrebsen zurückzugreifen. Der Test bietet dabei eine vergleichbare Sensitivität und Genauigkeit, kann mit den bestehenden Geräten ausgewertet werden und erfüllt gleichzeitig alle regulatorischen Anforderungen. Da Pfeilschwanzkrebse vom Aussterben bedroht sind, gewinnt der rFC-Assay zunehmend an Bedeutung. Der rFC-Assay soll daher auch an unserem Institut zeitnah den LAL-Assay ablösen.
4. Mykoplasmentestung mittels PCR (aktuell Messung am Institut Frankfurt)
Die Mykoplasmentestung mittels Polymerase Chain Reaction (PCR) ist eine sensitive Methode zum Nachweis von Mykoplasmen, also zellwandlosen Mikroorganismen, die Zellkulturen oder biopharmazeutische Produkte kontaminieren können. Beim Menschen können sie teils schwere Infektionen der Atemwege und des Urogenitaltrakts hervorrufen. Im Vergleich zu klassischen Kulturmethoden (Dauer 28 Tage) bietet die PCR eine schnellere und genauere Erkennung, indem sie spezifische DNA-Sequenzen von Mykoplasmen amplifiziert. Aus der entnommenen Probe wird die Mykoplasmen-DNA isoliert und mittels PCR vervielfältigt. Nach der Amplifikation erfolgt die Auswertung, die ein Vorhandensein von Mykoplasmen eindeutig nachweist. Auch diese Methode ist für die Qualitätssicherung in der Herstellung von ATMPs notwendig und wird von den regulatorischen Behörden als essentieller Freigabeparameter gefordert. Die Mykoplasmen-PCR wird aktuell von unserem Schwesterinstitut in Frankfurt am Main durchgeführt.
5. Durchführung von aseptischen Prozesssimulationen (APS, Media Fill)
Aseptische Prozesssimulationen (APS), auch Media Fills genannt, dienen der Validierung aseptischer Herstellungsprozesse sowie der (Re-)Qualifizierung der beteiligten Mitarbeiter, um nachzuweisen, dass während des Produktionsprozesses keine Kontaminationen auftreten. Dabei werden anstelle des eigentlichen (Zwischen-)Produkts geeignete Nährmedien wie Tryptic Soy Broth (TSB-Medium) im Produktionsprozess verwendet, welche das Wachstum von Mikroorganismen unterstützen und welche zu festgelegten Zeitpunkten während der APS als Proben unterschiedlichen Formats entnommen werden. Der gesamte Prozess, von der Befüllung bis zur Verpackung, wird dabei unter realistischen Bedingungen im Reinraum simuliert. Nach der Abfüllung werden die Medien über einen festgelegten Zeitraum inkubiert und auf mikrobielles Wachstum untersucht. Eine erfolgreich durchgeführte APS zeigt, dass der Prozess sicher und unter aseptischen Bedingungen durchgeführt werden kann. APS sind ein integraler Bestandteil der Qualitätssicherung in der Herstellung von ATMPs und anderen pharmazeutischen Produkten.
6. Sterilitätstestung einschließlich Inkubation, Prüfung und Dokumentation nach GxP-Leitlinien
Die Sterilitätstestung dient der Sicherstellung der mikrobiologischen Reinheit von Arzneimitteln und Medizinprodukten. Die Untersuchung der Proben aus aseptischen Prozesssimulationen (APS) erfolgt dabei nach GLP-Leitlinien (Good Laboratory Practice). Die Proben werden über 14 Tage bei festgelegten Temperaturen inkubiert und innerhalb dieser Zeit auf Trübung beobachtet. Die Auswertung erfolgt visuell, indem Trübungen oder Kolonien im Medium nachgewiesen werden. Alle Schritte, von der Vorbereitung über die Inkubation bis hin zur Auswertung, müssen sorgfältig dokumentiert werden, um die Rückverfolgbarkeit und Einhaltung regulatorischer Anforderungen sicherzustellen (Good Documentation Practice, GDP). Ebenso müssen alle Abweichungen und entsprechend getroffene Maßnahmen nachvollziehbar dokumentiert werden.
7. Fertilitätstestung (Growth Promotion Testing) mit Standardkeimen gemäß Europäischer Pharmacopoeia
Die Fertilitätstestung, auch Growth Promotion Test genannt, überprüft die Eignung von Nährmedien zur Unterstützung des Wachstums von Mikroorganismen. Gemäß Europäischer Pharmacopoeia (Ph. Eur.) werden Standardkeime wie Staphylococcus aureus, Escherichia coli und Candida albicans verwendet. Die Fertilitätstestung stellt sicher, dass Nährmedien für die Sterilitätsprüfung und andere mikrobiologische Tests geeignet sind. Dabei werden kleine Mengen der Standardkeime in das Medium eingebracht und über einen festgelegten Zeitraum inkubiert. Ein positives Ergebnis (Trübung) weist Wachstum der Mikroorganismen nach, was die Funktionsfähigkeit des Mediums bestätigt. Diese Prüfung ist essentiell, um die Verlässlichkeit mikrobiologischer Tests sicherzustellen. Neben dem Nachweis von Standardkeimen können regulatorische Behörden auch fordern, dass sogenannte Hauskeime, also Keime, die gelegentlich während des regulären Personalmonitorings nachgewiesen werden, in die Fertilitätstestung mit aufgenommen werden.
1. Quantitative Bestimmung von SARS-CoV-2-Spike-spezifischem IgG aus Serum
Die quantitative Bestimmung von SARS-CoV-2-Spike-spezifischem Immunglobulin G (IgG) aus Serum dient der Beurteilung der humoralen Immunantwort nach einer Infektion oder/und Impfung. Durch den ELISA (Enzyme-linked Immunosorbent Assay) können Antikörper im Blut erfasst werden, die gegen die S1-Domäne des Spike-Proteins gerichtet sind. Dies ermöglicht eine Beurteilung des Immunstatus und hilft auch dabei, die Wirksamkeit einer Impfung zu überprüfen oder Hinweise auf eine vergangene SARS-CoV-2-Infektion zu erhalten. Hierfür werden verdünnte Serumproben auf Mikrotiterplatten pipettiert, welche mit rekombinantem SARS-CoV-2-Spike-Antigen vorbeschichtet sind. Nach Inkubation und Messung der Platten in einem Photometer werden Extinktionswerte gemessen, von denen indirekt auf die Antikörperkonzentrationen geschlossen werden kann. Dabei werden Antikörperkonzentrationen ab 35,2 BAU/ml (Binding Antibody Units/ml) als positiv betrachtet, während grenzwertige Ergebnisse (32,0 - 35,2 BAU/ml) weitergehende Untersuchungen erfordern können. Die exakte Quantifizierung erfolgt über eine Standardkurve.
2. Semiquantitative Bestimmung von SARS-CoV-2-Nukleocapsid-spezifischem IgG aus Serum
Die semiquantitative Bestimmung von SARS-CoV-2-Nukleokapsid-spezifischem Immunglobulin G (IgG) aus Serum ermöglicht nicht nur die Erkennung einer zurückliegenden SARS-CoV-2-Infektion, sondern auch die Unterscheidung zwischen einer Infektion und einer Impfung. Während Impfungen in der Regel Antikörper gegen das Spike-Protein induzieren, weist der Nachweis von Antikörpern gegen das Nukleokapsidprotein (NCP) spezifisch auf eine durchgemachte Infektion hin. Die Bestimmung erfolgt mittels ELISA (Enzyme-linked Immunosorbent Assay). Nach Inkubation und Messung der optischen Dichte (OD) der zu untersuchenden Probe und einer Kalibratorprobe wird aus beiden ein Quotient gebildet (OD-Ratio). Eine OD-Ratio von ≥ 1,1 gilt dabei als positiv und lässt eine kürzlich zurückliegende Infektion vermuten.
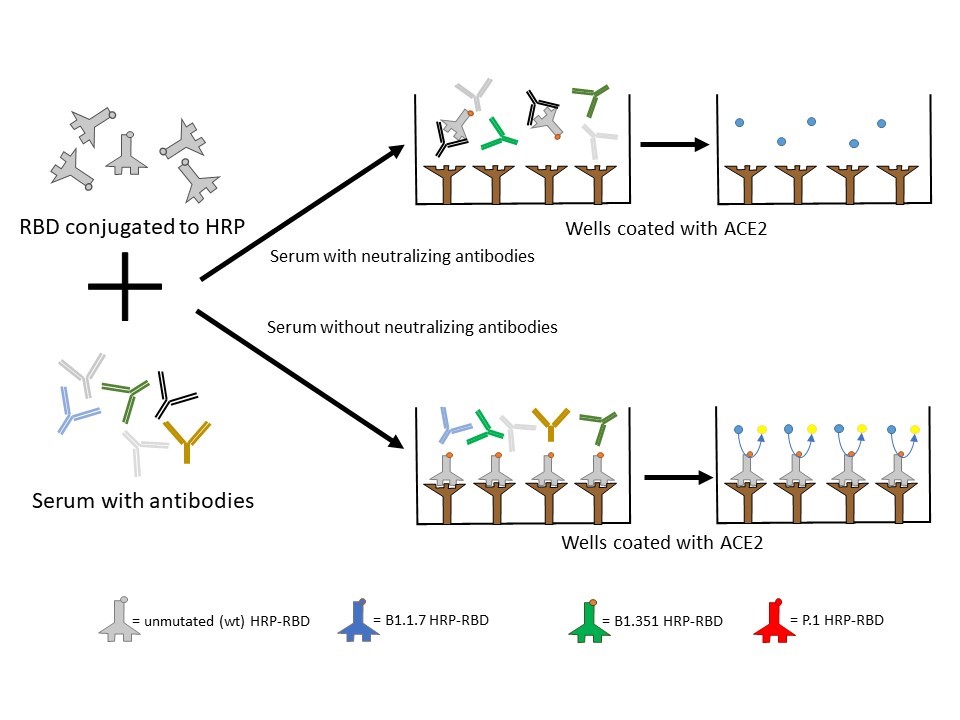
3. Bestimmung der SARS-CoV-2-spezifischen Neutralisationskapazität von Serum (Wildtyp und Omikronvarianten)
Die Bestimmung der SARS-CoV-2-spezifischen Neutralisationskapazität von Serum gegen den Virus-Wildtyp sowie die Omikron-Variante dient der Bewertung der schützenden Immunantwort nach einer Infektion mit SARS-CoV-2 oder entsprechender Impfung. Dieser Test erfasst dabei die Fähigkeit der im Serum enthaltenen Antikörper, die Bindung des Virus an ihren natürlichen Rezeptor Angiotensin Converting Enzyme 2 (ACE2) zu blockieren, wodurch eine Infektion verhindert wird. Die Ergebnisse liefern daher Hinweise darauf, wie gut der Körper gegen den ursprünglichen Wildtypstamm von SARS-CoV-2 sowie gegen die später aufgetretene Omikron-Variante geschützt ist. Neutralisationskapazitäten über 30% werden als schützend gewertet, Werte über 70% deuten auf eine starke Neutralisationskapazität hin. Dieser Assay hilft daher, den individuellen Schutzstatus noch differenzierter zu beurteilen als durch bloße Messung der Immunglobulinkonzentrationen im Serum.
4. Bestimmung SARS-CoV-2-spezifischer T-Zell-Aktivität (IFN-g-Release-Assay)
Die Bestimmung der SARS-CoV-2-spezifischen T-Zell-Aktivität erfolgt mithilfe des Interferon-gamma (IFN-γ)-Release-Assays (IGRA). Im Gegensatz zu den genannten serologischen Testmethoden misst dieser Test die T-Zell-vermittelte, also zelluläre Immunantwort gegen das SARS-CoV-2-Spike-Antigen. Er bietet damit eine wichtige Ergänzung zur Bestimmung der humoralen Immunität (Antikörper). Sind in einer hierfür abgenommenen Heparinblut-Probe SARS-CoV-2-spezifische T-Zellen enthalten, werden diese im Rahmen des Assays durch SARS-CoV-2-Peptide so stimuliert, dass sie zur Freisetzung von IFN-γ angeregt werden. Der Nachweis des IFN-γ im Überstand erfolgt dann mittels ELISA. Die Ergebnisse dieses Assays liefern klinische Hinweise auf die Aktivität der SARS-CoV-2-spezifischen T-Zellen und damit auf die zelluläre Immunität, die besonders für den längerfristigen Schutz gegen SARS-CoV-2 eine wichtige Rolle spielt.
Forschung & Entwicklung (Research & Development)
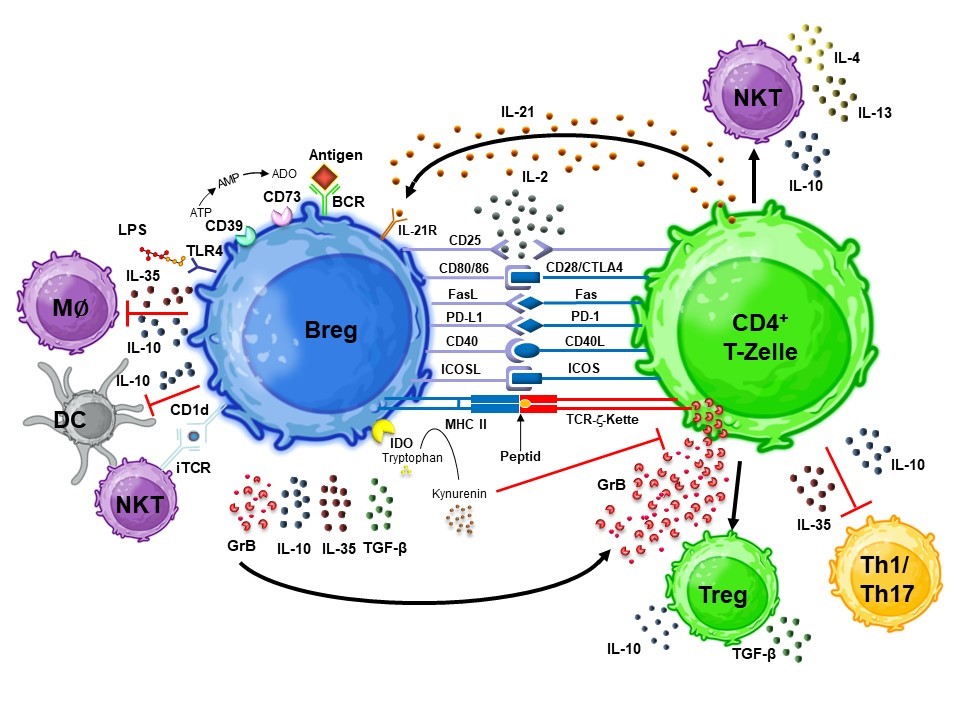
Regulatorische B-Zellen (Bregs) sind eine besondere Subpopulation von B-Lymphozyten, die eine zentrale Rolle bei der Modulation von Immunantworten und der Aufrechterhaltung der Immuntoleranz spielen. Sie können eine ganze Reihe von Moleküle freisetzen, darunter Interleukin-10 (IL-10) und Transforming Growth Factorβ (TGF-β), um Entzündungsreaktionen zu dämpfen. Eine spezifische Untergruppe von Bregs, sogenannte GraB-Zellen, ist in der Lage, das proteolytische Enzym Granzym B (GzmB) zu produzieren. Diese GraB-Zellen haben das Potenzial, überaktive Immunzellen direkt zu eliminieren und stehen daher im Fokus unserer Forschungen. Die Induktion regulatorischer B-Zellen wie GraB-Zellen erfolgt dabei durch eine gezielte Stimulation des B-Zell-Rezeptors und nachgeschalteter Signalwege, wobei auch Moleküle wie PMA und TLR-Agonisten eine wichtige Rolle spielen können. GraB-Zellen bieten aufgrund ihrer Fähigkeit, Granzym B freizusetzen und autoimmun wirksame Immunzellen direkt zu eliminieren, vielversprechende therapeutische Möglichkeiten für die Behandlung von Autoimmunerkrankungen, Transplantatabstoßung, chronische Entzündungen und Allergien. Forschungen der letzten Jahre lieferten entscheidende Einblicke in die Herstellung und Funktion dieser Zellen, so dass in den kommenden Jahren mit der Entwicklung eines GMP-konformen Herstellungsprozesses begonnen werden soll.
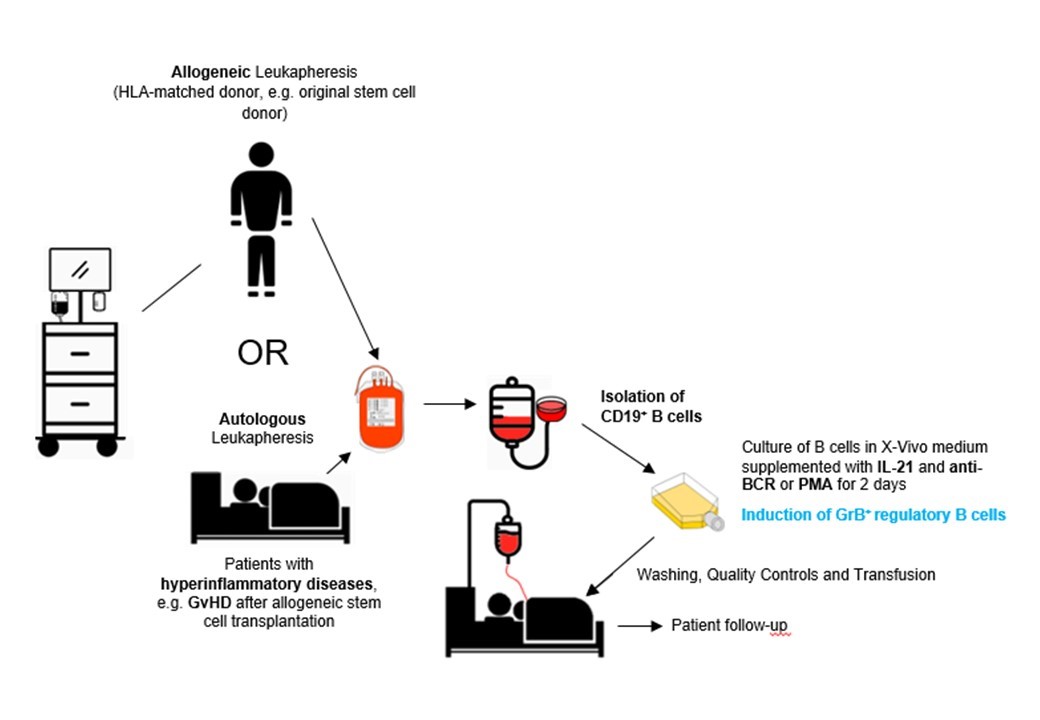
1. Gewinnung und Induktion von GraB-Zellen:
Prinzipiell erfolgt die Herstellung von GraB-Zellen durch Gewinnung von B-Zellen von Patienten (autolog) oder von Fremdspendern (allogen) über eine Apherese und magnetische B-Zell-Selektion sowie durch nachfolgende Reifung der B-Zellen über die direkte Stimulation des B-Zell-Rezeptors (BCR) und/oder der nachgeschalteten Signalwege. Verschiedene Stimuli, die direkt auf den BCR wirken oder Downstream-Signale aktivieren, spielen dabei eine entscheidende Rolle bei der Differenzierung von B-Zellen in Granzym B-sezernierende Zellen:
- BCR-Stimulation: Der B-Zell-Rezeptor (BCR) ist ein Schlüsselprotein, das die Aktivierung von B-Zellen steuert. Durch die direkte Stimulation des BCR wird eine Kaskade intrazellulärer Signale ausgelöst, die zur Reifung und Differenzierung von B-Zellen führt. Moleküle wie anti-IgM-Antikörper oder F(ab')2-Fragmente können zur BCR-Kreuzvernetzung verwendet werden, um diesen Prozess zu induzieren. Die Aktivierung des BCR führt zu einer verstärkten Produktion von Granzym B und der Umwandlung von B-Zellen in regulatorische GraB-Zellen. Dies wird insbesondere in Umgebungen beobachtet, in denen B-Zellen durch proinflammatorische Signale wie Interferon-γ (IFN-γ) und IL-21 stimuliert werden.
- PMA (Phorbol-12-Myristat-13-Acetat): PMA ist ein potenter Aktivator der Protein-Kinase C (PKC), eines Enzyms, das an der Signalübertragung nach BCR-Stimulation beteiligt ist. PMA kann zur BCR-unabhängigen Aktivierung von PKC verwendet werden und nachgeschaltete Signalwege initiieren, die ebenfalls zur Induktion von GraB-Zellen führen.
- Toll-like-Rezeptor (TLR)-Agonisten: Zusätzlich zur direkten BCR-Stimulation können Toll-like-Rezeptoren (TLRs) auf B-Zellen aktiviert werden, um die Differenzierung in GraB-Zellen zu unterstützen. TLR9-Agonisten wie CpG-Oligonukleotide fördern in Kombination mit BCR-Stimulation die Induktion von GraB-Zellen und verstärken die Granzym B-Produktion in inflammatorischen Mikroumgebungen.
2. Mechanismen der Immunsuppression durch GraB-Zellen: GraB-Zellen spielen eine wesentliche Rolle bei der Immunsuppression, indem sie Granzym B freisetzen, welches wiederum Apoptose in aktivierten T-Zellen induzieren kann. Granzym B, ein proteolytisches Enzym, ist ursprünglich als zytotoxisches Schlüsselmolekül von T-Zellen und natürlichen Killerzellen (NK-Zellen) bekannt. Bei GraB-Zellen führt es jedoch im Gegensatz dazu durch proteolytische Spaltung der Zeta-Kette des T-Zell-Rezeptors - und hat hierdurch eine immunsuppressive Wirkung.
Wir konnten zeigen, dass GraB-Zellen besonders effizient überschießende T-Zell-Antworten hemmen können, indem sie aktivierte T-Zellen mittels Granzym B an einer weiteren Proliferation hindern und in die Apoptose leiten. Dieser Mechanismus ist zytokinunabhängig und könnte in spezifischen klinischen Kontexten genutzt werden, in denen eine gezielte T-Zell-Elimination erwünscht ist, wie etwa bei Autoimmunerkrankungen oder Transplantatabstoßungen.
Weitere Untersuchungen zeigten, dass die Fähigkeit von GraB-Zellen zur Immunsuppression durch das Zusammenspiel mit anderen immunsuppressiven Zellen und Faktoren verstärkt werden kann. Dies deutet darauf hin, dass GraB-Zellen in einem komplexen immunregulatorischen Netzwerk eingebunden sind, welches zur langfristigen Immuntoleranz beiträgt.
3. Potentielle Anwendungen von GraB-Zellen:
Die spezifischen Eigenschaften von GraB-Zellen bieten vielversprechende therapeutische Ansätze für verschiedene immunologisch vermittelte Erkrankungen:
- Autoimmunerkrankungen: GraB-Zellen könnten bei Erkrankungen wie systemischem Lupus erythematodes (SLE), rheumatoider Arthritis und Multipler Sklerose genutzt werden, um die überschießende T-Zell-Antwort zu regulieren. Da GraB-Zellen durch die selektive Induktion von Apoptose in Effektor-T-Zellen wirken, könnten sie eine präzisere und spezifischere Immunregulation als herkömmliche Immunsuppressiva ermöglichen.
- Transplantationsmedizin: GraB-Zellen könnten in der Transplantationsmedizin eine Schlüsselrolle spielen, indem sie die Immunantwort gegen Transplantate gezielt dämpfen. Es wurde gezeigt, dass natürlich auftretende regulatorische GraB-Zellen Abstoßungsreaktionen bei Nierentransplantationen verhindern können, daher könnte der prophylaktische oder therapeutische Einsatz von GraB-Zellen hier besonders effektiv sein, indem sie aktivierte T-Zellen eliminieren und so die Immuntoleranz fördern.
- Chronische Entzündungen und Allergien: Da GraB-Zellen in der Lage sind, überschießende Immunantworten zu dämpfen, könnten sie auch bei chronischen Entzündungsreaktionen oder allergischen Erkrankungen eingesetzt werden. Durch die gezielte Modulation der T-Zell-Aktivität könnten sie dazu beitragen, überschießende Entzündungsreaktionen zu kontrollieren, ohne das Immunsystem in seiner Gesamtheit zu beeinträchtigen.
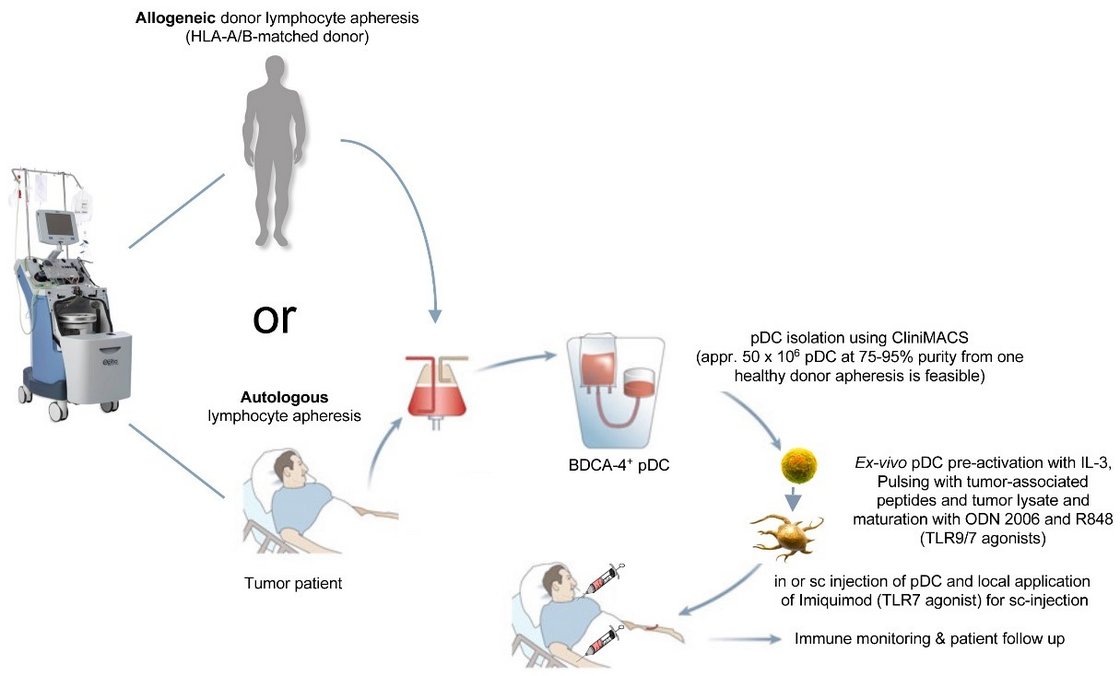
Plasmazytoide dendritische Zellen (pDCs) sind eine spezielle Subpopulation dendritischer Zellen, die durch ihre Fähigkeit, große Mengen an Interferon-alpha (IFN-α) zu produzieren, primär eine zentrale Rolle in der antiviralen Immunantwort spielen. Aufgrund ihrer immunstimulierenden Eigenschaften untersucht unser Labor in Kooperation mit dem Labor von Frau Prof. Dr. med. Dorit Fabricius (Klinik für Kinder- und Jugendmedizin, Universitätsklinikum Ulm), ob pDCs als Adjuvans in Impfstoffen eingesetzt werden könnten, um die Immunantwort nicht nur gegen Viren, sondern auch gegen Tumoren zu verstärken.
1. Gewinnung von plasmazytoiden dendritischen Zellen:
Die Gewinnung von pDCs erfolgt in mehreren Schritten, beginnend in der Regel mit einer Lymphozytapherese, einem Verfahren, bei dem angereicherte Lymphozyten aus dem Blutkreislauf eines Spenders entnommen werden. Bei der Apherese wird das Blut des Spenders durch einen Zellseparator geleitet, welcher die gewünschten Zellen separiert und den Rest des Blutes wieder in den Kreislauf des Spenders zurückführt. In einem zweiten Schritt erfolgt dann die Gewinnung von pDCs durch Isolation aus dem gesammelten Lymphozytapheresat. Ein gängiges Verfahren ist dabei die positive magnetische Selektion (MACS) mittels Antikörpern gegen spezifische Marker wie BDCA-2 und BDCA-4, die auf der Oberfläche von pDCs exprimiert werden.
Im Vergleich zu den in klinischen Studien bislang am häufigsten verwendeten Monozyten-abgeleiteten dendritischen Zellen (mono-DCs), deren ex-vivo-Reifung mindestens 7 Tage in Anspruch nimmt, können pDCs innerhalb von nur 24 Stunden nach ihrer Isolation aktiviert und maturiert werden. Auch deshalb eignen sich pDC als Vakzine oder Vakzineadjuvans besonders gut für potentielle klinische Anwendungen.
Grundsätzlich können pDCs sowohl aus dem Blut von autologen Spendern (z. B. Patienten) als auch von allogenen Fremdspendern (z. B. gesunde HLA-gematchte Spender) gewonnen werden. Zudem besteht die Möglichkeit, pDCs von haploidenten Spendern zu isolieren, also beispielsweise von blutsverwandten Kindern oder Eltern. Die beiden letztgenannten Optionen bieten den Vorteil, dass trotz guter Übereinstimmung des HLA-Profils des Spenders mit dem des Empfängers eine Immunantwort durch potenziell verbleibende allogene Effekte möglicherweise verstärkt werden könnte.
2. Maturierung von plasmazytoiden dendritischen Zellen:
Für eine effektive Aktivierung von pDC ist 2-stufiger Maturierungsprozess erforderlich, welcher bei einer geplanten Anwendung im klinischen Setting im Rahmen einer GMP-konformen (Good Manufacturing Practice) Herstellung im Reinraum durchgeführt werden muss:
- Phase 1: In einer ersten Phase produzieren pDCs zunächst in Reaktion auf verschiedene Zytokine wie Interleukin 3 (IL-3) und IL-10 große Mengen der Serinprotease Granzyme B (GzmB), welches einerseits die Aufnahme und Prozessierung von Antigenen unterstützen kann, andererseits die pDCs aber auch in ein tolerogenes bzw. immunregulatorisches Stadium versetzt, in dem sie T-Zell-Aktivierung eher unterdrücken als fördern.
- Phase 2: In der zweiten Phase erfolgt die eigentliche Maturation der pDCs durch Zugabe von Toll-like-Rezeptor (TLR-) Agonisten und ggf. CD40-Ligand. In diesem Stadium wird GzmB herunterreguliert, während gleichzeitig kostimulatorische Moleküle und MHC/Peptid-Komplexe hochreguliert werden. Die Maturierung mündet in einer hochimmunogenen und reifen Antigen-präsentierenden Zelle (APC). Der gesamte Reifungsprozess kann innerhalb von 24-48 Stunden abgeschlossen werden.
Die Notwendigkeit dieses 2-stufigen Prozesses ergibt sich zum einen aus dem Ziel, eine konsistente und reproduzierbare Aktivierung der Zellen zu gewährleisten, die für klinische Anwendungen entscheidend ist. Andererseits kann eine unzureichend maturierte pDC für die Wirksamkeit eines Vakzins sogar kontraproduktiv sein. Zudem trägt der 2-stufige Prozess potentiell auch zur Reduktion des Risikos unerwünschter Immunreaktionen bei, indem eine kontrollierte und gleichmäßige Aktivierung der pDCs gewährleistet wird.
3. Potentielle klinische Anwendungen von pDCs als Vakzineadjuvans:
Die Verwendung von pDCs als Adjuvans könnte vielversprechende klinische Anwendungen in verschiedenen Bereichen bieten:
- Tumorimmuntherapie: Im Rahmen von Tumorvakzinen könnten pDCs verwendet werden, um eine stärkere Immunantwort gegen Tumor-assoziierte oder -spezifische Tumorantigene zu induzieren. Es konnte gezeigt werden, das pDCs insbesondere nach TLR-Aktivierung das Tumor Microenvironment so modulieren können, dass die Aktivierung Tumor-spezifischer T-Zellen gefördert wird.
- Viruserkrankungen: Aufgrund ihrer natürlichen Fähigkeit, eine starke antivirale Immunität zu induzieren, könnten pDCs auch als Adjuvans in Impfstoffen gegen virale Infektionen eingesetzt werden und dadurch die Wirksamkeit solcher Impfstoffe erheblich verbessern.
- Autoimmunerkrankungen: Auf der anderen Seite könnten die immunregulatorischen Eigenschaften immaturer pDCs auch dazu genutzt werden, um Immuntoleranz zu fördern und eine überschießende Immunantwort bei Autoimmunerkrankungen zu dämpfen.
- Transplantationsmedizin: Auch in der Transplantationsmedizin könnten pDCs als immunmodulierendes Adjuvans verwendet werden, um Abstoßungsreaktionen zu dämpfen oder gar zu verhindern.
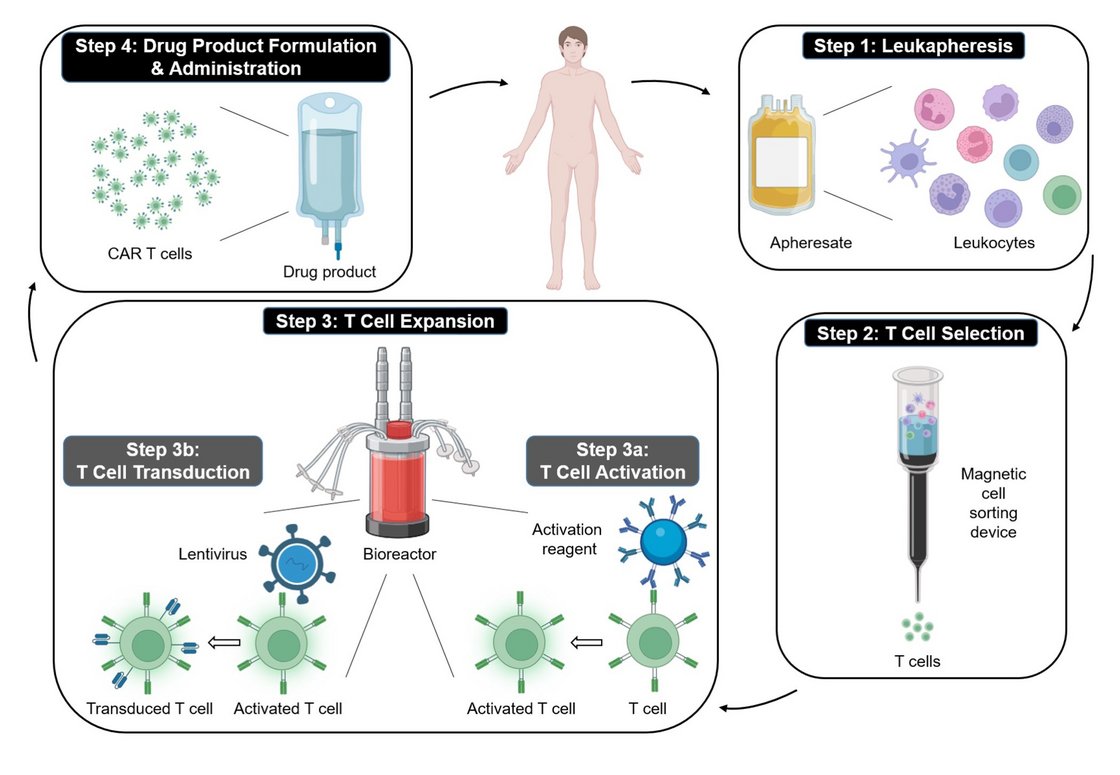
CAR-T-Zellen (Chimäre Antigenrezeptor-T-Zellen) stellen eine hochinnovative Form der Immuntherapie dar, die entwickelt wurde, um Tumorzellen gezielt zu bekämpfen. Sie kombinieren Eigenschaften von T-Zellen und B-Zellen in einer neuen Art von „Hybridzellen“. Normalerweise erkennen T-Zellen krankhafte Zellen über sogenannte T-Zell-Rezeptoren, die Antigene auf der Oberfläche der Zielzelle erkennen, nachdem sie von anderen Immunzellen präsentiert wurden. CAR-T-Zellen werden genetisch jedoch so modifiziert, dass sie chimäre Antigenrezeptoren (CARs) auf ihrer Oberfläche tragen, die wie ein B-Zell-Rezeptor direkt an spezifische Antigene binden können, ohne dass vorab eine Antigenpräsentation erforderlich ist. Dies verleiht ihnen die Fähigkeit, Tumorzellen eigenständig zu erkennen und zu zerstören, ohne von weiteren externen Signalen abhängig zu sein. Ausgangsmaterial hierfür können entweder Lymphozyten des Patienten selbst (autolog) oder von ausgewählten Fremdspendern (allogen) sein.
1. Herstellung von CAR-T-Zellen in verschiedenen Bioreaktoren:
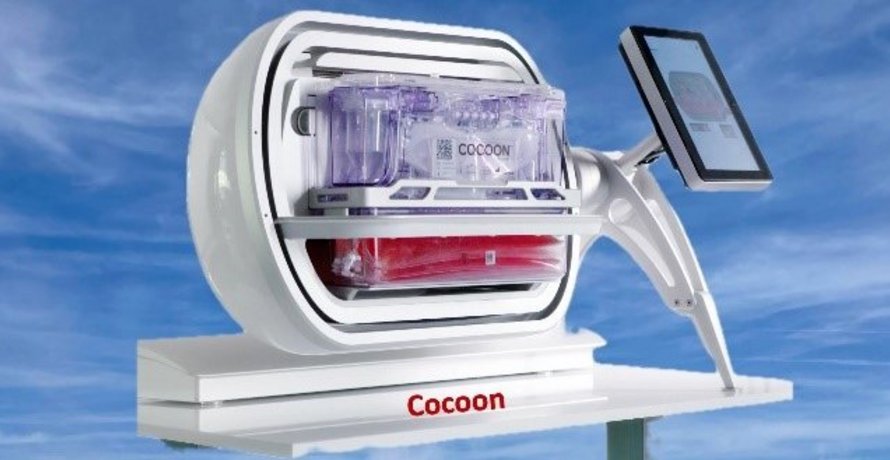
Die Herstellung von CAR-T-Zellen nach Gewinnung der T-Zellen erfolgt häufig in spezialisierten Bioreaktoren, die eine kontrollierte Umgebung bieten, um die Zellen genetisch zu verändern und zu expandieren. Die Cocoon-Plattform von Lonzaist dabei eine von mehreren Technologien, die die automatisierte und standardisierte Herstellung von CAR-T-Zellen erlauben. Bei der Cocoon Plattfom handelt es sich um ein modulares System, das speziell für die Herstellung autologer CAR-T-Zellen entwickelt wurde. Nach Selektion der T-Zellen, z.B. aus dem Lymphozytapheresat eines Patienten, erfolgt der gesamte Prozess von der genetischen Modifikation bis hin zur Expansion in einer geschlossenen, kontrollierten Umgebung. Dies minimiert das Risiko von Kontaminationen und reduziert die Notwendigkeit manueller Eingriffe. Die dadurch verringerte Arbeitszeit ermöglicht es, Patientenproben parallel in mehreren Bioreaktoren zu verarbeiten, was die Effizienz deutlich steigert.
Im Vergleich zu den in klinischen Studien bislang am häufigsten verwendeten Monozyten-abgeleiteten dendritischen Zellen (mono-DCs), deren ex-vivo-Reifung mindestens 7 Tage in Anspruch nimmt, können pDCs innerhalb von nur 24 Stunden nach ihrer Isolation aktiviert und maturiert werden. Auch deshalb eignen sich pDC als Vakzine oder Vakzineadjuvans besonders gut für potentielle klinische Anwendungen.
Grundsätzlich können pDCs sowohl aus dem Blut von autologen Spendern (z. B. Patienten) als auch von allogenen Fremdspendern (z. B. gesunde HLA-gematchte Spender) gewonnen werden. Zudem besteht die Möglichkeit, pDCs von haploidenten Spendern zu isolieren, also beispielsweise von blutsverwandten Kindern oder Eltern. Die beiden letztgenannten Optionen bieten den Vorteil, dass trotz guter Übereinstimmung des HLA-Profils des Spenders mit dem des Empfängers eine Immunantwort durch potenziell verbleibende allogene Effekte möglicherweise verstärkt werden könnte.
Neben der Cocoon-Plattform gibt es mehrere andere Systeme zur Herstellung von CAR-T-Zellen, die sich in ihrer Effizienz und Handhabung unterscheiden und verschiedene Vorteile in Bezug auf Skalierbarkeit, Flexibilität und Automatisierung bieten.
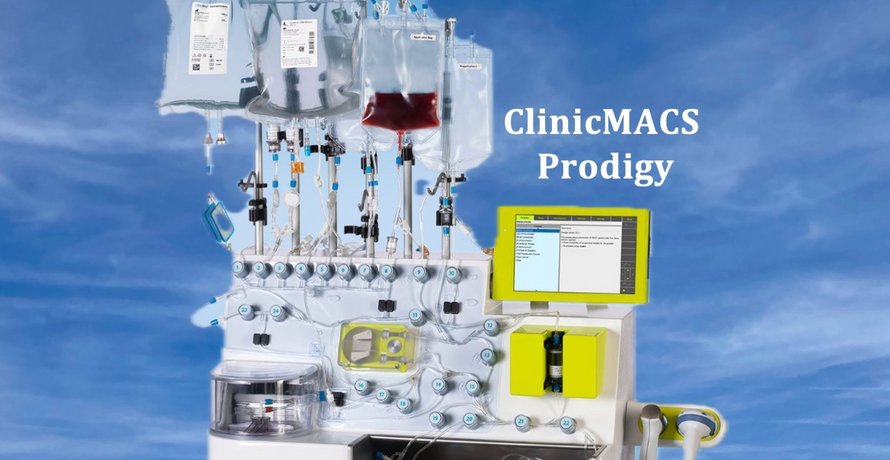
- CliniMACS Prodigy (Miltenyi Biotec)
Dieses System bietet eine automatisierte, geschlossene Plattform für die Herstellung von CAR-T-Zellen. Es deckt den gesamten Prozess der Zellmanipulation ab, von der Selektion der Zellen über deren genetische Modifikation bis hin zur Expansion. Es ist besonders für kleinere Produktionsmengen geeignet und zeichnet sich durch Flexibilität aus, da es auf unterschiedliche Herstellungsanforderungen anpassbar ist.
- Xuri Cell Expansion System (Cytiva)
Dieses skalierbare Zellkultursystem wird zur Expansion von CAR-T-Zellen in größeren Produktionsmengen verwendet. Das sogenannte Wave-Bioreaktor-System bietet eine präzise Kontrolle der Wachstumsbedingungen und nutzt Einweg-Bioreaktorbeutel, was es besonders für großvolumige Produktionen interessant macht.
- Quantum Cell Expansion System (Terumo BCT)
Der Quantum-Bioreaktor nutzt eine hohlfaserbasierte Zellkulturtechnologie, die ebenfalls eine geschlossene Umgebung bietet. Dies ermöglicht eine kontinuierliche Nährstoffzufuhr und effiziente Zellvermehrung.
2. Anwendung von CAR-T-Zellen:
CAR-T-Zellen haben sich besonders bei der Behandlung hämatologischer Tumorerkrankungen bewährt:
- Akute lymphatische Leukämie (ALL): Besonders bei Kindern und Jugendlichen, die auf andere Therapien nicht ansprechen, haben CAR-T-Zellen beeindruckende Ergebnisse erzielt.
- Non-Hodgkin-Lymphom (NHL) und chronische lymphatische Leukämie (CLL): Auch bei diesen Krebsarten zeigen CAR-T-Zelltherapien vielversprechende Erfolge, vor allem bei Patienten, die gegen herkömmliche Therapien resistent sind.
- Multiples Myelom: Studien zeigen, dass CAR-T-Zellen auch gegen das multiple Myelom, eine schwer behandelbare Form von Blutkrebs, wirksam sind.
Zukünftige Anwendungen könnten sich auch auf die Behandlung solider Tumoren wie Brust-, Lungen- oder Bauchspeicheldrüsenkrebs ausweiten. Allerdings stehen Forscher hier vor der Herausforderung, dass solide Tumore eine komplexe Mikroumgebung aufweisen, die das Eindringen der CAR-T-Zellen erschwert. Aktuelle Forschungsansätze zielen darauf ab, diese Hindernisse zu überwinden.
Vergleich der Effizienz von mRNA- und Vektorimpfstoffen gegen SARS-CoV-2 durch kontinuierliches Immunmonitoring
Unter den zugelassenen Impfstoffen gegen SARS-CoV-2, den Erreger von COVID-19, sind in Deutschland sogenannte mRNA- und Vektorimpfstoffe zur Anwendung gekommen. Um sowohl unerwünschte Wirkungen als auch ihre Wirksamkeit in der Praxis zu beurteilen, war es während der Corona-Pandemie besonders wichtig, nicht nur die Immunantwort nach einer Infektion mit SARS-CoV-2, sondern auch nach entsprechenden Impfungen schnell und unabhängig von herstellenden Pharmafirmen zu untersuchen bzw. zu vergleichen. Im Rahmen des in unserer Abteilung etablierten Immunmonitoring-Programms und in Kooperation mit dem Institut für Molekulare Virologie waren wir dadurch in der Lage, in einer sehr frühen Phase der Pandemie nicht nur die Effizienz der verschiedenen Impfstofftypen zu vergleichen, sondern insbesondere auch Prognosen im Hinblick auf neu auftretende Virusvarianten zu treffen. Unser Immunmonitoring-Programm bot zudem die Grundlage für zwei an unserem Institut durchgeführte klinische Studien mit Hyperimmunplasma, welches von rekonvaleszenten gesunden Plasmaspendern gewonnen wurde (s.a. Abteilung Spende & Plasmapherese).
1. Mechanismus und Funktionsweise der SARS-CoV-2-Impfstofftypen
Vektorimpfstoffe wie ChAdOx1-nCoV-19 (AstraZeneca) und Ad26.COV2.S (Johnson & Johnson) verwenden ein modifiziertes Virus, um genetisches Material des SARS-CoV-2 Spike-Proteins in infizierte Zellen einzuschleusen. Die entsprechenden Zellen produzieren daraufhin zunächst mRNA, welche für das Spike-Protein kodiert und in einem weiteren Schritt dann aus der mRNA das Spike-Protein selbst. Fragmente des Proteins werden schließlich auf der Zelloberfläche präsentiert, was im günstigsten Fall eine Immunantwort auslöst, da es sich um fremdes antigenes Material handelt.
mRNA-Impfstoffe wie BNT162b2 (BioNTech/Pfizer) und mRNA-1273 (Moderna) liefern den Bauplan für das SARS-CoV-2 Spike-Protein über synthetische mRNA, welche die Zellen direkt und ohne den Umweg der zellulären Synthese von mRNA anregt, das Spike-Protein herzustellen. Wie bei Vektorimpfstoffen werden Fragmente des Spike-Proteins auf der Zelloberfläche präsentiert, wo es dann ebenfalls eine spezifische Immunantwort auslöst.
2. Effizienz der Impfstoffe
Die beschriebenen Unterschiede der beiden Impfstofftypen resultieren in variierenden Immunantworten, welche sich auch in der Wirksamkeit der Impfstoffe widerspiegeln. Die Effizienz beider Impfstofftypen wurden in groß angelegten klinischen Studien untersucht. Dabei zeigten mRNA-Impfstoffe eine höhere Schutzwirkung, die bei etwa 94-95% gegen symptomatische COVID-19-Erkrankungen lag, während Vektorimpfstoffe eine Wirksamkeit von nur ca. 60-80 % aufwiesen.
Ein zentraler Befund unserer eigenen Studien war, dass mRNA-geimpfte Personen bereits innerhalb von drei Wochen nach der ersten Impfung signifikant höhere neutralisierende Antikörper-Titer aufwiesen als bei Impfung mit Vektorimpfstoffen. Diese Überlegenheit von mRNA-Impfstoffen gegenüber Vektorimpfstoffen zeigte sich auch in einer stabileren Langzeitimmunität, die auf eine fortschreitende Affinitätsreifung der produzierten Antikörper hindeutet. Zudem konnten wir zeigen, dass bei sogenannten heterologen Impfschemata (d.h. erste Dosis vektorbasiert, weitere Impfdosen mRNA-basiert) eine stabile und langanhaltende Immunität induziert wurde, welche zum Teil auch Schutz gegen die sich später entwickelnden Virusvarianten bot.