Es sind unterschätzte genetische Steuerelemente: Dass Veränderungen im Erbgut Diabetes auslösen können, ist bekannt. Doch nun haben Forschende des Universitätsklinikums Ulm und des INSERM Cochin Instituts in Paris gezeigt, dass auch eine bisher wenig erforschte Region des Erbguts eine entscheidende Rolle bei der Entstehung dieser Erkrankung spielt. Die deutsch-französische Kooperation hat aufgedeckt, dass eine Region der „nicht-kodierenden DNA“ die Aktivität des Diabetes-Gens ONECUT1 maßgeblich beeinflusst. Die Ergebnisse des Projekts wurden in der renommierten Fachzeitschrift Cell Reports veröffentlicht – und eröffnen neue Wege für personalisierte Therapien.
„Im Fokus unserer Forschung stand ein junger Patient unserer französischen Partner, bei dem bereits im Säuglingsalter eine seltene Form von Diabetes aufgrund einer Mutation im ONECUT1-Gen diagnostiziert worden war“, erklärt Professor Alexander Kleger, Direktor des Instituts für Molekulare Onkologie und Stammzellbiologie (IMOS) der Universität Ulm und Leiter der Sektion Interdisziplinäre Pankreatologie der Klinik für Innere Medizin I. „Er war bei der Geburt deutlich kleiner und leichter als andere Neugeborene, wies Fehlbildungen an den Fußzehen auf, hatte eine stark verkleinerte Bauchspeicheldrüse und keine Gallenblase.“ Im Teenageralter verschlechterte sich sein Zustand dramatisch, mit schweren Magen-Darm-Blutungen und fortschreitender Leberzirrhose. Als junger Erwachsener verstarb er schließlich an einer Komplikation der Krankheit. „Zwar war bekannt, dass ONECUT1 eine wichtige Rolle bei der Entwicklung der Bauchspeicheldrüse und der Leber sowie bei der Entstehung dieser seltenen Form von Diabetes spielt“, so Kleger, „allerdings konnte dies nicht die außergewöhnliche Schwere der Erkrankung erklären.“
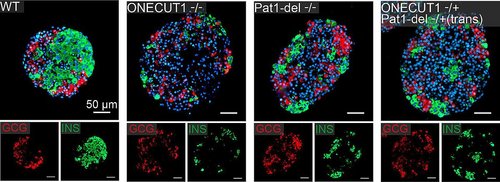
Das Forschungsteam am IMOS hat humane Stammzellen genetisch so verändert, dass sie die spezifischen Mutationen dieses Patienten widerspiegeln. Daraus erzeugte es Vorläuferzellen der Bauchspeicheldrüse und untersuchte diese mithilfe moderner molekularbiologischer Methoden. In Zusammenarbeit mit weiteren Ulmer Forschungsinstituten (Humangenetik, Transfusionsmedizin) kam unter anderem eine besondere Form zur Analyse des menschlichen Erbguts zum Einsatz, die sogenannte Nanopore-Sequenzierung. Außerdem wurde die räumliche Struktur des Chromatins untersucht, um zu verstehen, wie unterschiedliche Teile der DNA im Zellkern zusammenwirken. Abschließend setzten die Forschenden die CRISPR-Cas9-Technologie ein, die auch als Genschere bekannt ist, um gezielt eine nicht-kodierende Region des Genoms zu entfernen und deren Einfluss auf die Entwicklung der Bauchspeicheldrüse zu untersuchen.
Dieser nicht-kodierende Teil enthält Elemente, die die Genaktivität steuern können – während der kodierende Bereich die Bauanleitung für die Proteine vorgibt. Lange Zeit galt der nicht-kodierende Bereich als funktionslose „Junk-DNA“, doch die Forschenden in Ulm machten genau dort eine wichtige Entdeckung. „Wir fanden heraus, dass dem Patienten an dieser Stelle ein Stück des Erbgutstrangs fehlte. Dabei handelte es sich um einen ‚Enhancer‘ – ein Element, das die Transkription der DNA in RNA fördert und somit die Genaktivität verstärkt“, erklärt die Ulmer Biologin Dr. Sandra Heller. Obwohl dieses Element räumlich weiter vom ONECUT1-Gen entfernt liegt, beeinflusst es dennoch dessen Aktivität. ONECUT1 ist maßgeblich für die Entwicklung der Beta-Zellen und damit für die Insulinproduktion in der Bauchspeicheldrüse.
Während die Forschenden aus Ulm und Paris dieses Enhancer-Element durch genetische Analysen in der DNA des Diabetespatienten identifizierten, wurde es in den USA von einer Forschergruppe durch ein CRISPR-Screening entdeckt. „Bei anschließenden Untersuchungen in humanen pluripotenten Stammzellen“, erklärt IMOS-Doktorandin Sarah Merz, „erzielten beide Teams übereinstimmende und sich ergänzende Ergebnisse.“ Auch die US-amerikanische Studie wurde kürzlich in Cell Reports veröffentlicht.
Vielversprechender Ansatz für eine personalisierte Diabetes-Therapie
Die Entdeckung der Forschenden eröffnet neue Möglichkeiten für eine gezielte Diabetesbehandlung. So testeten sie verschiedene, bereits bei Typ-2-Diabetes eingesetzte Medikamente an Zellen, die die genetischen Veränderungen des Patienten nachbildeten. Einige dieser Medikamente verbesserten die gestörte Insulinsekretion – ein vielversprechender Ansatz für personalisierte Therapien. „Unser Ziel ist es, die Therapie individuell an die genetischen Besonderheiten der Patientinnen und Patienten anzupassen, um bessere Behandlungsergebnisse zu erzielen. Um ein solches Projekt umsetzen zu können, braucht es einzigartige Partnerschaften auf Augenhöhe, weswegen ich meiner Kollegin Cécile Julier vom INSERM Cochin Institut in Paris besonders dankbar bin“, erklärt Professor Alexander Kleger.
Die Erkenntnisse des deutsch-französischen Teams sind nicht nur für die Behandlung von Patientinnen und Patienten mit seltenen genetischen Mutationen von Bedeutung, sondern auch für jene mit dem weit verbreiteten Typ-2-Diabetes. Denn in der neu identifizierten Region fanden die Forschenden auch eine genetische Variation, die mit einem höheren Risiko für häufige Formen von Diabetes einhergeht. Durch die gezielte Analyse dieser Bereiche könnten künftig auch genetisch maßgeschneiderte Behandlungsmöglichkeiten für diese Betroffenen entwickelt werden. „Unsere Arbeit zeigt, dass das nicht-kodierende Genom eine weitaus größere Rolle bei der Krankheitsentstehung spielen kann als bisher angenommen“, betont Alexander Kleger. Nun sei es wichtig, in der genetischen Diagnostik umzudenken und solche regulatorischen Elemente verstärkt zu untersuchen – um den Mechanismen komplexer Erkrankungen wie Diabetes auf die Spur zu kommen.
Das Projekt wurde durch die Deutsche Forschungsgemeinschaft (DFG) und das Medical Scientist Programm der Universität Ulm gefördert und in Kooperation mit Partnern wie dem Institut für Humangenetik der Universität Ulm, der Klinik für Innere Medizin I, dem Institute for Computational Genomics der RWTH Aachen sowie dem Institut für Klinische Transfusionsmedizin und Immungenetik Ulm durchgeführt.
Hintergrund: Das ONECUT1-Gen befindet sich auf Chromosom 15 beim Menschen und spielt eine zentrale Rolle bei der Entwicklung von Leber und Bauchspeicheldrüse sowie bei Stoffwechselprozessen. Bereits 2021 konnten die Ulmer Forschenden zeigen, dass Mutationen in ONECUT1 die Entstehung bestimmter Diabetes-Formen stark beeinflussen. Diese Erkenntnisse sind wichtig für die personalisierte Medizin, da manche Fälle von vermeintlichem Typ-2-Diabetes möglicherweise auf eine Veränderung in nur einem Gen zurückzuführen sind und gezielt behandelt werden könnten.
Publikationshinweis:
Merz, S., Heller, S., Kleger, A., Julier, C. et al. (2024). A ONECUT1 regulatory, non-coding region in pancreatic development and diabetes. Cell Reports, Volume 43, Issue 11, 2024 https://doi.org/10.1016/j.celrep.2024.114853
Text: Anja Burkel | Medienkontakt: Daniela Stang