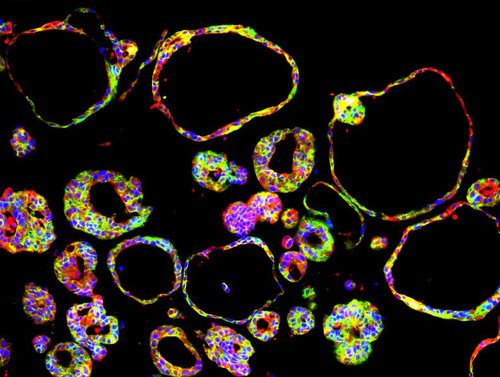
Ulmer Forschende haben eine Bauanleitung für Bauchspeicheldrüsen-Organoide entwickelt, die durch Gen-Editierung mutationsspezifische Tumore ausbilden. Mithilfe solcher stammzellbasierten Modelle aus dem Labor wollen die Autorinnen und Autoren der Ulmer Universitätsmedizin die frühe Entstehung von Bauchspeicheldrüsenkrebs nachvollziehen und womöglich neue therapeutische Angriffspunkte identifizieren. In Zukunft sollen diese künstlich hergestellten, duktalen Pankreas-Organoide auch dazu beitragen, Tierversuche zu reduzieren. Der aktuelle, in Kooperation mit dem HelmholtzZentrum München entstandene Fachbeitrag ist im Journal „Cell Stem Cell“ erschienen.
Bauchspeicheldrüsenkrebs (hier: duktales Pankreaskarzinom) zählt zu den tödlichsten Krebsarten: Aufgrund unspezifischer Symptome wie Gewichtsverlust oder Bauchschmerzen wird der Tumor oft erst so spät entdeckt, dass eine Heilung nicht mehr möglich ist. Deshalb ist ein detailliertes Verständnis der frühen Krebsentstehung wichtig, um rechtzeitig und gezielt in den Krankheitsverlauf eingreifen zu können. In der Forschung werden neben Mausmodellen vor allem aus Patientenproben gewonnene Tumorzellen als Modelle eingesetzt, die allerdings nur späte Stadien der Tumorerkrankung abbilden. Doch jetzt haben Ulmer Forschende um den Studienleiter Professor Alexander Kleger Bauchspeicheldrüsen-Modelle – so genannte duktale Pankreas-Organoide – hergestellt, aus denen gezielt Tumore entwickelt und von Anfang an beforscht werden können. Diese Mini-Organe aus dem Labor, die einen bestimmten Zelltyp der Bauchspeicheldrüse nachahmen, werden aus menschlichen, pluripotenten Stammzellen gezüchtet. Dabei handelt es sich um „Alleskönner-Zellen“, aus denen verschiedenste Zelltypen und Gewebe des Körpers entstehen können.
Ausgehend von solchen pluripotenten Stammzellen haben die Forschenden eine „Bauanleitung“ für die Herstellung dreidimensionaler, „duktaler“ Organoide entwickelt, deren strukturelle und funktionale Eigenschaften dem Gangsystem der Bauchspeicheldrüse („Ductus pancreaticus“) entsprechen, das Verdauungsenzyme in den Zwölffingerdarm transportiert. „In unserem Modell starten wir mit einem definierten genetischen Hintergrund und können davon ausgehend gezielt krebsfördernde Gene einschalten und die mutationsspezifischen Auswirkungen in den Organoiden beobachten“, erklären die Ulmer Erstautoren Markus Breunig und Jessica Merkle. In derZellkultur ist es den Wissenschaftlerinnen und Wissenschaftlern bereits gelungen, die Entstehung von Krebsvorstufen in den Modellen auszulösen und zu untersuchen. In die Bauchspeicheldrüsen von Mäusen transplantiert, entwickelten sich diese Dysplasien bereits nach acht Wochen zu spezifischen Tumoren weiter.
Bei ihrer wissenschaftlichen Arbeit greifen die Forschenden auf Gen-Editierung, Stammzell-Reprogrammierung und weitere biomedizinische Methoden zurück. Dadurch können sogar hochindividuelle, patientenspezifische Pankreas-Modelle für Untersuchungen hergestellt werden: „Besonders vielversprechend ist die Möglichkeit, personalisierte duktale Organoide zu züchten, indem beispielsweise Haare von genetisch vorbelasteten Patientinnen und Patienten zu pluripotenten Stammzellen ,reprogrammiert‘ werden“, erläutert Seniorautorin Dr. Meike Hohwieler, Gruppenleiterin an der Ulmer Universitätsklinik für Innere Medizin I.
Auch um die Ausbildung von Metastasen zu verstehen, planen die Forschenden nun längerfristige Untersuchungen mit den duktalen Pankreas-Organoiden. Darüber hinaus soll das Protokoll zur Herstellung der Mini-Organe so optimiert werden, dass eine Übertragung ins Mausmodell nicht mehr nötig ist. Auf längere Sicht lassen sich so womöglich Tierexperimente in der Krebsforschung reduzieren. „Insgesamt können wir mithilfe der neuen Differenzierungsplattform genau definierte Pankreaskarzinome aus Stammzellen herstellen, in denen sich die Auswirkungen individueller Genmutationen untersuchen lassen. Somit hoffen wir, das Zusammenspiel mit anderen Ereignissen der Krebsentstehung in Zukunft besser zu verstehen – oder sogar individualisierbare therapeutische Ansätze für diese Krebsart zu identifizieren“, resümieren die Seniorautoren, Heisenberg-Professor Alexander Kleger und Dr. Matthias Meier vom Pioneer Campus am HelmholtzZentrum München. Mit den Münchner Ingenieuren arbeiten die Wissenschaftlerinnen und Wissenschaftler der Ulmer Universitätsmedizin bereits an einer technisch miniaturisierten Weiterentwicklung der Differenzierungsplattform, um Biomarker für die Früherkennung von Bauchspeicheldrüsenkrebs aus diesen Krankheitsmodellen ableiten zu können.
Die Forschenden aus Ulm (Universitätsklinik für Innere Medizin I, Universitätsklinik für Urologie und Kinderurologie, Institut für Pathologie), München, Dresden, Tübingen sowie aus dem ungarischen Szeged und den USA wurden vor allem durch die Deutsche Forschungsgemeinschaft (DFG) und die Baden-Württemberg Stiftung unterstützt. Weitere Fördermittel kamen von der Deutschen Krebshilfe, vom Bundesministerium für Bildung und Forschung (BMBF) und von der Else Kröner-Fresenius-Stiftung.