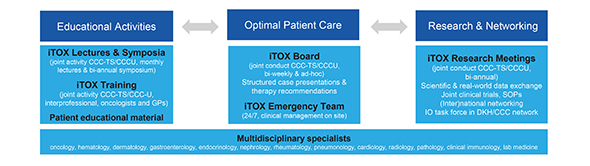
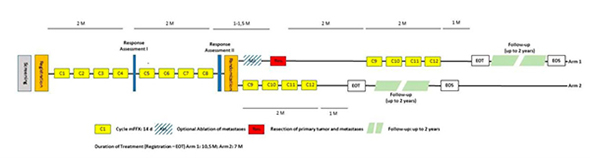
|
Studienname/Sponsor
|
Entität(en)
|
Prüfsubstanz
|
20180257 Amgen
Eine offene Phase-1b-Studie zur Untersuchung der Sicherheit und Pharmakokinetik der Verabreichung von subkutanem Blinatumomab zur Behandlung von Erwachsenen mit rezidivierter oder
refraktärer B-Zell-Vorläufer akuter lymphoblastischer Leukämie (R/R B-ALL)
|
ALL
|
Blinatumumab (bispezifischer Antikörper CD3/CD19)
|
GMALL-BLIVEN
Eine offene Phase-I/II-Studie mit Venetoclax als Ergänzung zur Blinatumomab Immuntherapie bei erwachsenen Patienten mit rezidivierter/refraktärer akuter B-Zell-Vorläufer akuter
lymphoblastischer Leukämie (BCP-ALL)
|
ALL
|
Blinatumumab (bispezifischer Antikörper CD3/CD19)
|
75276617ALE1002
Eine Phase-1b-Prüfung zu JNJ-75276617 in Kombination mit Therapien zur Behandlung der akuten myeloischen Leukämie (AML) bei Patienten mit AML mit KMT2A- oder NPM1 Veränderungen
|
AML
|
Menin /KMT2A Inhibitor
|
MOLIVO-1
Phase-Ia/IIb-Studie mit dem PHD-Inhibitor Molidustat in Kombination mit dem IDH1-Inhibitor Ivosidenib bei Patienten mit rezidivierter/refraktärer akuter myeloischer Leukämie oder
myelodysplastischem Syndrom mit Blasenexzess-2 mit IDH1-Mutation
|
AML, MDS
|
HIF-Stabilisator, IDH1-Inhibitor
|
BGB-11417-103
Offene Phase 1b/2-Dosisfindungs- und Erweiterungsstudie des Bcl-2-Inhibitors BGB-11417 bei Patienten mit myeloischen Malignomen
|
AML
|
BCL2-Inhibitor
|
CD45RADLIHaplo
Eine multizentrische Phase-I/II-Studie mit Infusionen von Gedächtnis-T-Zell-Spender-Lymphozyten nach der Transplantation von CliniMACS TCRalpha/beta- und CD19-abgereicherten
Stammzelltransplantaten von haploidentischen Spendern für die Transplantation hämatopoetischer Zellen
|
AML
|
haploidente Stammzelltransplantation
|
AVC-201-01
Multizentrische, offene Phase-1-Studie mit Allo-RevCAR01-T-CD123 bestehend aus gentechnisch veränderten T-Zellen, die Reverse Chimeric Antigen-Rezeptoren (Allo-RevCAR01-T) in Kombination mit CD123
Zielmodul (R-TM123) für die Behandlung von Patienten mit ausgewählten Hämatologischen Malignomen, die positiv für CD123 sind
|
AML
|
Allogene CD123 CAR-T-cells
|
UC02-123-01
Multizentrische, offene Phase I Studie mit Dosissteigerungen für die Behandlung von Patienten mit CD123 positiven hämatologischen und lymphatischen Malignomen mittels gentechnisch
veränderten T-Zellen, die universelle chimäre Antigen-Rezeptoren (UniCAR02-T) auf der Oberfläche tragen, und in Kombination mit einem CD123-spezifischen Zielmodul (TM123) verabreicht werden
|
AML, B-ALL, BPDCN (CD123 pos.)
|
CD123 CAR-T-cells
|
BO43243
Eine offene, multizentrische Phase-Ib-Studie zur Beurteilung der Sicherheit, Wirksamkeit und Pharmakokinetik von Mosunetuzumab bei Patienten mit rezidivierter oder refraktärer chronischer
lymphatischer Leukämie
|
CLL
|
Mosunetuzumab (bispezifischer Antikörper CD3/CD20)
|
BGB-16673-101
Eine offene Studie der Phase 1/2 zur Dosiseskalation und Dosisexpansion des Bruton Tyrosine Kinase Targeted Protein Degrader BGB-16673 bei Patienten mit B-Zell-Malignomen
|
CLL, B-NHL
|
BTK-Degrader
|
M22-132
Offene Studie der Phase Ib/II zur Beurteilung der Sicherheit und Verträglichkeit von Epcoritamab in Kombination mit antineoplastischen Wirkstoffen bei Patienten mit Non Hodgkin-Lymphom
|
B-NHL, CLL
|
Epcoritamab in Kombination mit z.B. Polatuzumab etc
|
M23-647
Erste Studie am Menschen zur Bewertung der Sicherheit, Pharmakokinetik und vorläufige Wirksamkeit des BTK Degraders, ABBV-101, bei Teilnehmern mit B-Zell Malignomen.
|
CLL, B-NHL
|
BTK-Degrader
|
M24-291
Eine Phase-1-Studie zur Bewertung der Sicherheit, Pharmakokinetik und Wirksamkeit von ABBV-453 bei erwachsenen Probanden mit rezidivierter oder refraktärer chronischer lymphatischer Leukämie
(CLL)/kleinem lymphatischen Lymphom (SLL)
|
CLL
|
BCL2-Inhibitor
|
TITANium
Eine modulare offene Dosiseskalations- und Dosiserweiterungsstudie der Phase I/II zur Bewertung der Sicherheit, Pharmakokinetik, Pharmakodynamik und Wirksamkeit von AZD5492, einem T-Zellen-bindenden
Antikörper gegen CD20 bei Patienten mit rezidivierten oder refraktären B-Zell-Malignitäten
|
DLBCL, FL, MCL, CLL, SLL
|
Bispezifischer Antikörper (CD8/CD20)
|
INCA 33989-101
Eine offene, multizentrische Phase-1-Studie zu INCA033989, verabreicht als Monotherapie oder in Kombination mit Ruxolitinib bei Teilnehmern mit myeloproliferativen Neoplasien
|
MPN
|
Ruxolitinib
|
BELI(E)VE
Kombinationsbehandlung von Belantamab Mafodotin und Venetoclax bei der Behandlung von rezidiviertem und refraktärem t(11;14) Multiplen Myelom (Phase I/IIa)
|
Multiples Myelom
|
Belantamab / Venetoclax
|